
Gigantes del sector como Novo Nordisk, Elli Lilly y Pfizer han invertido en fármacos contra la obesidad y el sobrepeso, que se ha triplicado en la población, pero pueden enfrentarse también a problemas reputacionales.

Gigantes del sector como Novo Nordisk, Elli Lilly y Pfizer han invertido en fármacos contra la obesidad y el sobrepeso, que se ha triplicado en la población, pero pueden enfrentarse también a problemas reputacionales.
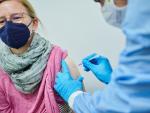
La EMA y la Comisión Europea la han considerado apta para administrarse como dosis de refuerzo a pacientes adultos que ya hayan cumplido la primera pauta de inmunización con otra vacuna.
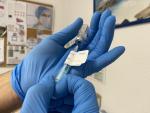
La farmacéutica espera que la EMA conceda la autorización en unas semanas y comenzar a distribuir sus dosis por países europeos que se han mostrado su interés por usarla como refuerzo contra el covid.

La dosis de refuerzo de Hipra genera una potente respuesta de anticuerpo superior a la obtenida con Pfizer-BioNTech.

La comisaria de Salud recomienda a los gobiernos europeos administrar la cuarta dosis lo antes posible a las personas mayores de 60 y la población de alto riesgo ante el aumento de casos por las vacaciones.

Los técnicos del Ministerio de Sanidad y las comunidades de la ponencia de alertas han culminado un protocolo para la detección precoz de los casos, de los que hay siete confirmados y una veintena en estudio
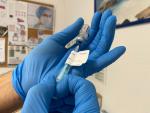
El conseller de Salud ha explicado que la vacuna de la empresa farmacéutica catalana Hipra "está en muy buena situación y posición" para superar la fase de evaluación de la Agencia Europea del Medicamento.

El país destinará casi 200 millones de euros a este paquete de ayudas, así como otros 100 millones para fortalecer los sistemas públicos de salud a través de proyectos relacionados con la Covid-19.

"Actualmente no existe ninguna evidencia de que la respuesta inmune después de la vacunación sea significativamente diferente con ómicron, pero las vacunas continúan ofreciendo una alta protección".
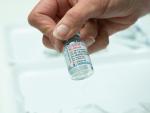
Este trastorno da lugar a una hinchazón de brazos y piernas, un aumento sin previo aviso de peso, una sensación de desmayo, un espesamiento de la sangre o una bajada de la presión arterial.
El PRAC recomendó la inclusión de una advertencia en la información del producto de Moderna para concienciar a los profesionales sanitarios y a los pacientes del riesgo potencial de reagudización.
El organismo asegura que no existe evidencia que respalde administrar una segunda dosis de refuerzo de la vacuna contra el coronavirus en esta franja de edad, contrario al criterio de algunos países europeos.

Las restricciones del visado ruso dentro del paquete de sanciones que prepara Bruselas pone en jaque al sector de los viajes, ante la imposibilidad de recibir este verano a un turista con alto poder adquisitivo.

Los expertos recuerdan que España tarda 453 días de media para que un fármaco sea aprobado para su financiación tras el visto bueno de la EMA.

Sánchez indica que la ventaja de este antiviral es su administración por vía oral, lo que permitiría realizar un tratamiento ambulatorio de los pacientes leves con factores de riesgo para la progresión a Covid grave.

La agencia solo recomienda el uso de Paxlovid cuando aparezcan los primeros síntomas de la enfermedad y pone el énfasis en los grupos de personas que sufren diabetes, obesidad o enfermedades pulmonares.

La ministra Carolina Darias ha explicado que se fijarán criterios técnicos asesorados por expertos y que serán "determinados pacientes" los que podrán recurrir a él.

El respaldo de la Agencia Europea del Medicamento da luz verde a su implementación en la Unión Europea y servirá para tratar contagiado que no necesitan oxígeno pero con alto riesgo de enfermedad grave.

Estos cambios permitirán la producción de unos 25 millones de dosis adicionales de la vacuna de Moderna cada mes para la Unión Europea y para terceros países a través de COVAX.
La Agencia Europea de Medicamentos (EMA) respaldó el pasado jueves la extensión de la actual licencia europea de las farmacéuticas Pfizer y BioNTech para usarla en niños entre 5 y 11 años.
La directora de la Agencia Europea del Medicamento, Emer Cooke, ha señalado que la agencia cuenta con planes para acelerar la adaptación pero "no sabemos si se va a necesitar".

Comenzó a evaluar el pasado 18 de octubre los datos obtenidos en los ensayos clínicos con el objetivo de poder extender el uso de la vacuna Covid-19 de BioNTech/Pfizer, también denominada Comirnaty.
Producir un medicamento supone 2.500 millones de inversión en 10 años y se patentan 50 anualmente. Un año de retraso en el acceso a un tratamiento significa un año menos de vida para los enfermos graves.

La decisión se basa en los datos que demuestran que una tercera dosis de esta vacuna administrada entre 6 y 8 meses después de la segunda provoca un aumento de los niveles de anticuerpos.
Tiene actualmente autorización de la Comisión Europea para inyectarse en personas mayores de 12 años desde el pasado mayo.
Página 1 de 10