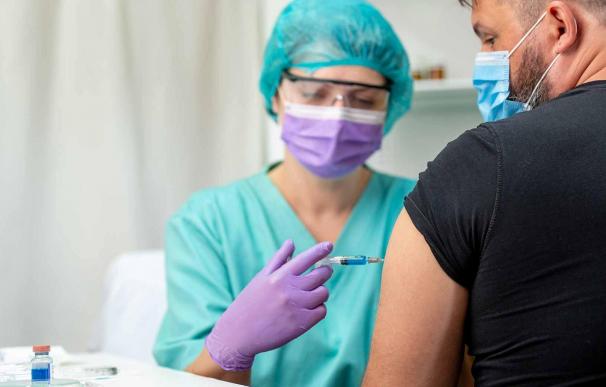
España ha autorizado el primer ensayo clínico para probar en humanos una vacuna contra la Covid-19 en nuestro país. Las pruebas, según ha anunciado el ministro de Sanidad, Salvador Illa, se realizarán en 190 ciudadanos sanos de entre 19 y 55 años y los centros elegidos son los hospitales de La Paz y La Princesa, en Madrid, y el Marqués de Valdecilla, en Santander.
La vacuna que se probará en España es la de los laboratorios Janssen, propiedad de la multinacional Johnson & Johnson y se realizará en Fase II, es decir se testa en humanos. La Agencia Española de Medicamentos y productos Sanitarios ha sido la encargada de autorizar estos ensayos en nuestro país. Las pruebas también se realizarán en Alemania y Bélgica alcanzando a algo más de 500 humanos.
El reclutamiento de voluntarios comenzará la semana que viene o "de forma inminente", en palabras de Illa y correrá a cargo de la compañía promotora. Pero, ¿qué ley ampara a los todo aquel dispuesto a participar?
La legislación en España y Europa
La legislación sobre los ensayos clínicos está fijada en el Boletín Oficial del Estado (BOE) mediante el Real Decreto 1090/2015, por el que se regulan los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos.
Según reza el escrito: "La investigación clínica con medicamentos constituye el elemento básico que permite que los medicamentos sean autorizados por las agencias de medicamentos, que sean comercializados por sus titulares con las garantías que la legislación exige y que lleguen finalmente a la práctica clínica para beneficio de los pacientes".
Es en el artículo 7 de este Real Decreto el que hace referencia a 'ensayos clínicos en situaciones de urgencia', que asume que "cuando el ensayo tenga un interés específico para la población en la que se realiza la investigación, y lo justifiquen razones de necesidad en la administración del medicamento en investigación, podrá someterse a una persona a una ensayo clínico sin obtener el consentimiento que se cita en los artículos anteriores".

Ensayos en situaciones de urgencia
¿Supone esto que no sería necesario un consentimiento como tal? No, para ello, el BOE hace referencia a los dos primeros supuestos del Reglamento Europeo 536/2014 sobre ensayos clínicos de medicamentos de uso humano, al que hay que recurrir en estos casos.
De acuerdo al primer artículo de este texto: "En un ensayo clínico hay que proteger los derechos, la seguridad, la dignidad y el bienestar de los sujetos de ensayo, y los datos obtenidos deben ser fiables y sólidos. Los intereses de los sujetos de ensayo deben tener primacía sobre cualquier otro interés". Y en segunda instancia: "Para que sea posible un control independiente del respeto de estos principios, un ensayo clínico debe estar sometido a autorización previa".
¿Qué pasa con la indemnización si hay algún problema?
Según el reglamento de la UE: "En los ensayos clínicos, debe garantizarse una indemnización por daños y perjuicios cuando se solicite con éxito de conformidad con la legislación aplicable. Por consiguiente, los Estados miembros deben velar para que existan mecanismos de indemnización de los daños y perjuicios sufridos por un sujeto de ensayo que sean acordes con la naturaleza y el alcance del riesgo".
¿Se puede ganar mucho dinero con los ensayos clínicos?
No. Al menos, no demasiado. Según la Ley en España, se puede pagar una pequeña suma por las molestias. La cantidad varia, pero nunca podrá ser tan elevada como para que alguien justifique su participación solo por las ganancias.


Hemos bloqueado los comentarios de este contenido. Sólo se mostrarán los mensajes moderados hasta ahora, pero no se podrán redactar nuevos comentarios.
Consulta los casos en los que lainformacion.com restringirá la posibilidad de dejar comentarios